新闻动态
2018年10月,全球第一款RNA药物onpattro®获批上市,这是诺贝尔奖成果从概念走向实际治疗用途的一个里程碑。多年来的技术发展和积累,核酸药物作为新一代治疗方法初露峥嵘,随着mRNA疫苗的获批,RNA药物进入蓬勃发展期。
为了确保这些RNA分子能够有效地进入细胞并发挥作用,脂质纳米粒功不可没。它可以保护RNA分子不被体内酶分解,将其输送到体内特定部位。脂质纳米粒的成分通常包括胆固醇、辅助磷脂(DSPC,DOPE等)、聚乙二醇化脂质(DMG-mPEG20000,DSPE-mPEG2000以及阳离子脂质(DOTAP,DOTMA,D-Lin-MC3-DMA等)。
脂质体,作为脂质纳米粒的前身。它们是由磷脂双分子层自发形成的封闭小囊泡,与细胞膜结构相似,可以模拟细胞膜的性质。脂质体于20世纪60年代被Bangham等人发现,最初是用作研究细胞膜结构和功能的简便模型,随着技术的进步和更深入的研究,脂质体逐渐发展为一种潜在的药物递送载体。由于其两亲性的结构,脂质体可以携带多种不同的药物。亲水性药物可以封闭在脂质体的水性内部区域,而疏水性药物可以包裹在脂双层的烃链区域中,如下图。
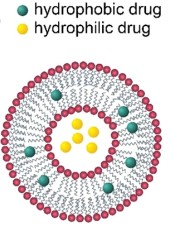
用于药物递送的脂质体主要由各类磷脂和胆固醇构成,其中磷脂(甘油磷脂和鞘磷脂)是其基本骨架。甘油磷脂是以甘油为骨架的脂质,鞘磷脂是以鞘氨醇为骨架的脂质,下图是甘油磷脂和鞘磷脂的基本结构。
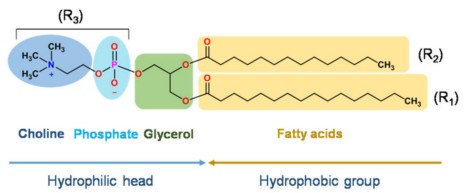
甘油磷脂结构示意图
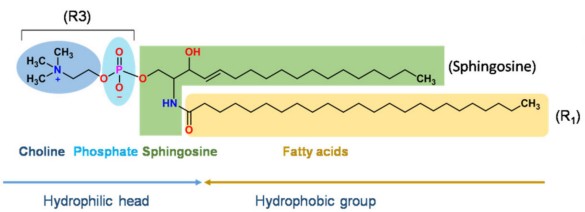
鞘磷脂结构示意图
注:R1和R2可以是饱和脂肪酸或不饱和脂肪酸,如月桂酸、棕榈酸、油酸、芥酸等。R3在不同的pH值下可以是中性的磷脂酰胆碱(PC)、磷脂酰乙醇胺(PE),也可以是负荷电的磷脂酰丝氨酸(PS)、磷脂酰肌醇(PI)、磷脂酸(PA)、磷脂酰甘油(PG)。
胆固醇是一种两亲性中性脂质,可以调节脂质双分子层的流动性,通过增加脂质体的稳定性,减少药物的泄露,起到延长和控制药物释放的作用。
除了磷脂和胆固醇,脂质体还可以添加多糖(如寡聚糖、壳聚糖、透明质酸)和表面活性剂等膜材料,以提高脂质体的稳定性并调控药物的释放。
根据不同的结构和性能,脂质体可以分为单层脂质体、多层脂质体和多囊脂质体等类型。此外,根据脂质体所带电荷,可以分为阳离子脂质体(如DOTAP)、阴离子脂质体(如DOPS)和中性脂质体(如DSPE)。根据不同的功能,还有长循环脂质体、糖基修饰脂质体、热敏脂质体、pH敏感脂质体、免疫脂质体、磁性脂质体和弹性脂质体等。
脂质体属于热不稳定体系,容易出现药物泄露和降解等问题。为了实现靶向治疗,稳定性是脂质体不可或缺的因素。脂质体的稳定性包括物理稳定性、化学稳定性和生物稳定性。物理稳定性和化学稳定性通常是指脂质体制剂在一定时间内保持其特性的能力。磷脂容易发生化学降解反应,如酯键水解和不饱和酰基链的过氧化反应,这些现象会影响脂质体制剂的长期稳定性。另外,为了保持脂质体囊泡结构的完整,需要平衡脂质体内部和脂质体之间的各种相互作用力。选择饱和磷脂或低饱和度的磷脂、合适的双层浓度、适当的缓冲液种类,以及添加抗氧化剂、金属螯合剂和冷冻保护剂等都可以增加脂质体的稳定性。
生物稳定性指的是在血清蛋白存在的情况下,脂质体能够保持其完整性。在血液中,脂质体与血清蛋白结合后,会发生调理作用,导致脂质体被快速清除。为了增强生物稳定性,可以添加聚乙二醇(PEG)等物质来避免调理作用,延长脂质体在血液中的循环时间。
脂质体在结构上与生物膜相似,具有很好的生物相容性,脂质体作为药物载体,具有以下优势:
1. 可以携带不同种类的药物/基因:脂质体特殊的双分子层结构,可以封闭和保护多种不同类型的药物和基因,包括水溶性和脂溶性药物。
2. 具有不同途径给药的潜力:脂质体可以通过不同的途径进行给药,包括口服、注射、局部应用等,可以根据具体需要选择最适合的给药途径。
3. 防止化学和生物降解:脂质体与细胞膜结构相似,可以保护药物免受化学和生物降解的影响,延长药物的半衰期,提高药物的稳定性和生物利用度。
4. 降低药物的非特异性副作用和毒性:脂质体可以将药物封闭在内部,减少药物对非靶向组织的影响,降低非特异性副作用和毒性,提高药物的疗效和治疗指标。
5. 多功能性的化学修饰和靶向能力:脂质体可以进行化学修饰,通过附着特定的配体或功能基团实现靶向效果,提高药物的靶向性和选择性。
6. 生物降解、无毒材料相容:脂质体可以与可生物降解且无毒的材料相容,减少对人体的不良影响。
由于脂质体具有良好的生物相容性、无毒性和多样化的药物携带能力,脂质体在药物递送系统中具有广泛的应用前景。Doxil的研究成功,鼓舞了脂质体载药体系的研究与开发,因而脂质体被广泛应用于各大疾病治疗领域。
脂质体在药物递送领域中最主要的应用是癌症治疗。癌症是一种身体健康细胞失控分裂的疾病,被认为是本世纪的一大医学挑战。通常来讲,肿瘤部位的血管通透性通常更高,脂质体可以通过毛细血管上皮细胞靶向进入肿瘤组织,此外,脂质体结构具有高度的灵活性,可以修饰各种聚合物和配体等,提高稳定性的同时实现更好的靶向效果。脂质体能够携带具有不同物理化学特性的药物,因此被认为是纳米医学中药物递送和癌症治疗的理想选择。在癌症治疗领域,脂质体载药体系显示出了巨大的潜力。多年来,随着研究的深入,脂质体作为抗肿瘤药物载体的治疗途径和方法也越来越广泛,目前已有一些用于癌症治疗的药物如Marqibo®(长春新碱)、力朴素(紫杉醇)和Onivyde®(伊立替康)等。
另一个重要的应用领域是抗真菌治疗。真菌感染对人类健康构成越来越大的威胁,尤其对于免疫缺陷人群,侵袭性真菌感染的发病率和死亡率尤为突出。生物膜作为真菌的天然屏障,会影响抗真菌药物对菌体的作用,降低药物的摄取,使得抗真菌药物难以发挥效用。脂质体作为药物载体具有良好的生物相容性,可以降低药物的毒副作用。与生物膜相似的结构能够与微生物细胞质膜融合,将高浓度的药物释放到细胞膜或细胞质中,实现更高效的输送和避免药物外排。目前用于抗真菌治疗的药物有两性霉素B类脂质体,如Ambisome®、Abelcet®和Amphotec®等。
除了癌症治疗和抗真菌治疗,脂质体在其他领域也有广泛的应用。例如在眼部疾病治疗中,使用脂质体载药体系治疗眼部感染。此外,脂质体还可用于抗疟疾治疗、制备脂质体疫苗(如流感疫苗)、克服生物屏障(如血脑屏障,治疗阿尔茨海默病)等方面取得了不错的成果。
然而,脂质体的大规模生产一直面临挑战,且成本较高,这导致脂质体在市场上的定位偏高。尽管如此,随着科学技术的进步,人们对脂质体和纳米医学作为药物递送系统持续发展的期望依然很高。
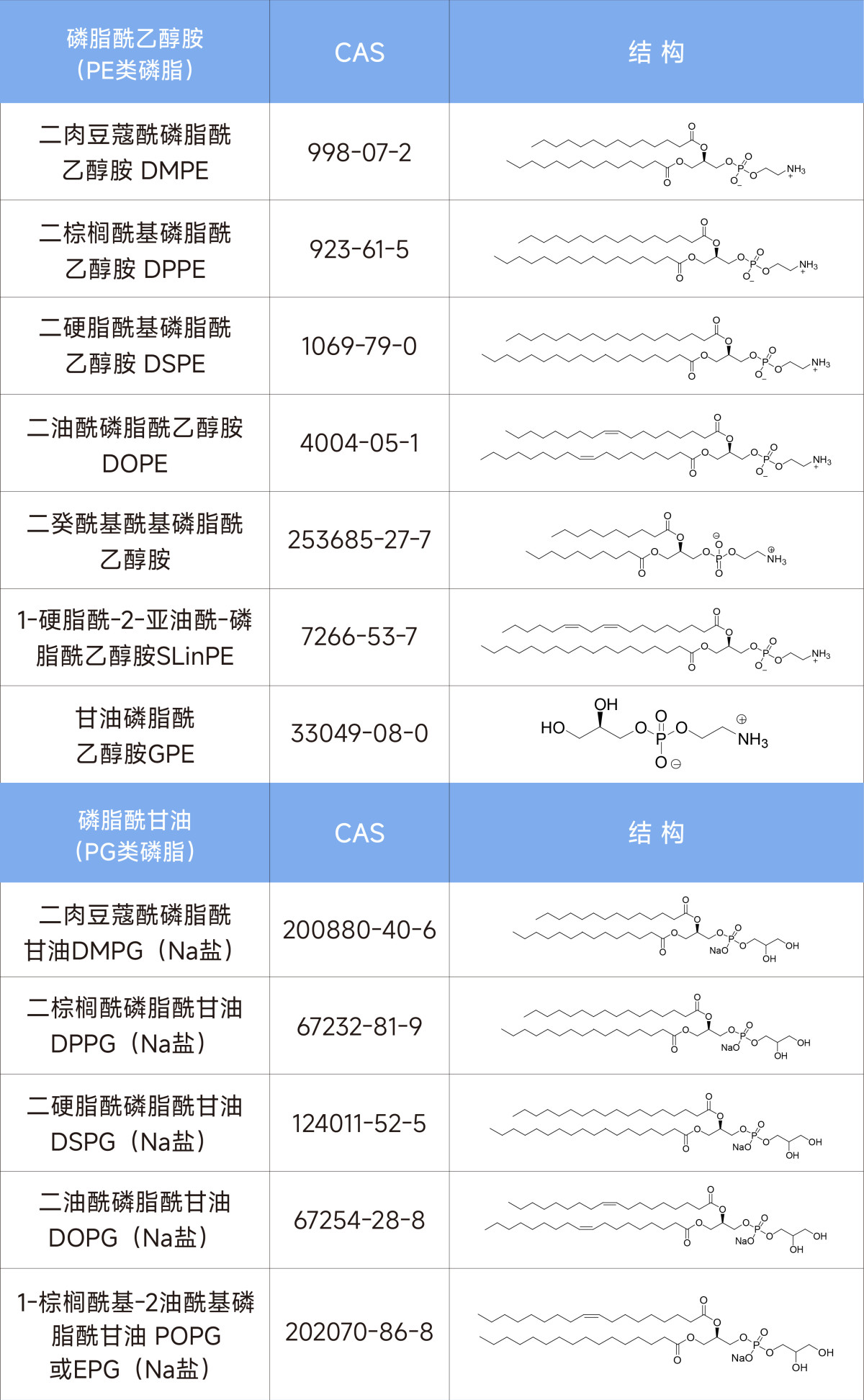
苏州昊帆生物股份有限公司成立于2003年,专注于缩合剂、多肽药物、抗体偶联药物的双官能试剂以及脂质体膜材等领域。在脂质体领域,本公司可以为脂质体科研工作者提供种类丰富的各类磷脂试剂和相关膜材,欢迎来电垂询(具体产品见表1)。
表1 昊帆的脂质体膜材产品



参考文献:
[1]Pattni,B.S.;Chupin,V.V.;TorchilinV.P.NewDevelopmentsinLiposomalDrugDelivery[J].Chem.Rev.2015,115,10938-10966.
[2]杨福愉.脂质体(Liposome)在生物膜研究和药物学方面的应用[J].生物化学与生物物理进展.1977,06,36-40.
[3]Tenchov,R.;Bird,R.;Zhou,Q.Q.;etal.LipidNanoparticles─FromLiposomestomRNAVaccineDelivery,aLandscapeofResearchDiversityandAdvancement[J].ACSNano.2021,15,16982-17015.
[4]Liu,P.;Chen,G.L.;Zhang,J.C.AReviewofLiposomesasaDrugDeliverySystem:CurrentStatusofApprovedProducts,RegulatoryEnvironments,andFuturePerspectives[J].Molecules.2022,27,1372-1394.
[5]刘扬,吕万良,张强.脂质体及纳米粒药物递送系统的研究进展[J].中国医学科学院学报.2006,28,583-589.
[6]Hussain,A.;Singh,S.;Sharma,D.;etal.Elasticliposomesasnovelcarriers:recentadvancesindrugdelivery[J].IntJNanomedicine.2017,12,5087-5108.
[7]Torchilin,V.P.Recentadvanceswithliposomesaspharmaceuticalcarriers[J].NatRevDrugDiscov.2005,4,145–160.
[8]Filipczak,N.;Pan,J.Y.;Yalamarty,S.S.K.;etal.Recentadvancementsinliposometechnology[J].AdvancedDrugDeliveryReviews.2020,156,4-22.
[9]Large,D.E.;Abdelmessih,R.G.;Fink,E.A.;etal.Liposomecompositionindrugdeliverydesign,synthesis,characterization,andclinicalapplication[J].AdvancedDrugDeliveryReviews.2021,176,113851
[10]黄梓源,孙玉琦,胡海洋,庄蕊,徐琪,陈大为.脂质体制剂学稳定性的研究技术与方法[J].药学学报,2016,51,356-361.
[11]Samad,A.;Sultana,Y.;Aqil,M.LiposomalDrugDeliverySystems:AnUpdateReview[J].CurrentDrugDelivery.2007,4,297-305.
[12]Ebrahim,S.;Peyman,G.A.;Lee,P.J.ApplicationsofLiposomesinOphthalmology[J].SurvOphthalmol.2005,50,167-182.
[13]Nsairat,H.;Khater,D.;Sayed,U.;etal.Liposomes:structure,composition,types,andclinicalapplications[J].Heliyon.2022,8,9394.
[14]Rommasi,F.;Esfandiari,N.LiposomalNanomedicine:ApplicationsforDrugDeliveryinCancerTherapy[J].NanoscaleResLett.2021,16,95.
[15]陈水生,周可倩,李晓东,吕权真,俞媛.纳米药物递释系统在抗真菌感染治疗中的应用及机制.药学学报,2021,56,1893-1901.

