新闻动态
有机叠氮化物是合成含氮化合物的重要中间体,叠氮基团在大部分情况下是稳定的,但在特殊条件下它表现出特征反应性。例如,有机叠氮化物与等当量的伯胺反应,并用于Staudinger反应。叠氮化物的光敏性也被广泛用于研究配体-靶受体及其结合位点结构的光亲和性标记。最近,Cu(I)催化的反应被发现非常可靠,并被广泛用于点击化学(链接化学),从而有机叠氮化物和末端炔烃的1,3-偶极反应(Huisgen反应)再次进入有机化学合成领域的中心阶段。
有机叠氮化合物的合成方法一直在高速发展,其中有机叠氮化合物中带有离去基团的亲核取代反应较为常用。芳基卤化物和芳基重氮盐是用作亲电试剂,前者需要在离去基团的对位或邻位具有强的吸电子基团,而后者作为底物受到限制,因为芳基重氮盐是具有高度活性的中间体。借助催化剂Cu(Ⅱ),三氟甲磺酰基叠氮化物(TfN3)将重氮转移至伯胺是合成有机叠氮化物的替代方法。该方法在温和的反应条件下进行,转化只需要一步反应且产率高。然而,TfN3具有爆炸性,需要非常小心的处理。近期有报道称咪唑-1-磺酰叠氮化物盐酸盐可为重氮转移试剂,它是结晶性固体,在80℃(分解温度)以下是稳定的,具有与TfN3几乎相同的反应性。
Mitsuru团队报道了2-叠氮基-1,3-二甲基咪唑鎓氯化物(ADMC)是1,3-二羰基化合物的有效重氮转移试剂。在该反应中,重氮化产物容易分离,因为唯一可检测的副产物1,3-二甲基-2-咪唑啉酮(DMI)易溶于水,可通过用水洗涤反应液去除,从而得到纯度较高的重氮化合物。
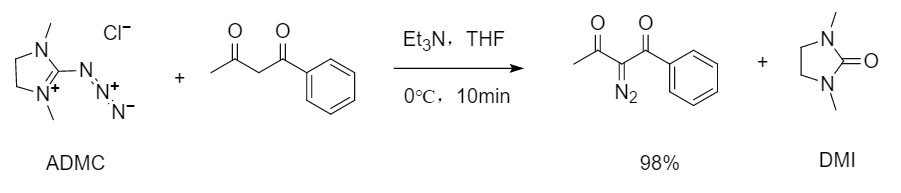
图1
然而,ADMC由于其吸湿性在其合成过程中分离度较差。相反,相应的2-叠氮基-1,3-二甲基咪唑鎓六氟磷酸盐(ADMP)则为稳定的晶体结构,分离度较好,并且有着较强的向伯胺重氮转移的能力。冲击敏感性试验和摩擦敏感性测试表明ADMP的爆炸性在可控范围内,图2显示了ADMP在200℃左右时观察到放热分解。这些结果表明ADMP可以在其分解温度以下安全使用,优选在不超过100℃使用更加安全可靠。
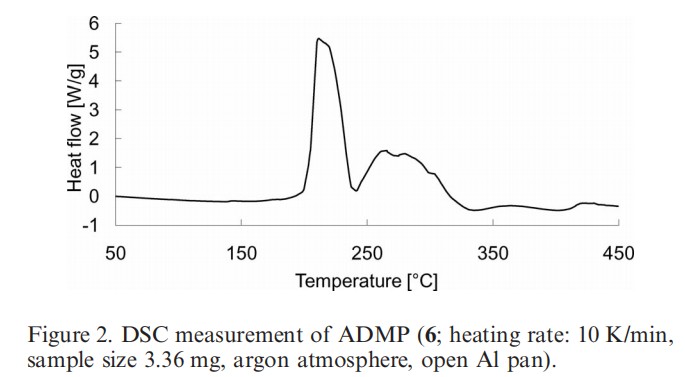
图2
选用ADMP与对位取代的苯胺进行重氮转移实验,首先与4-甲氧基苯胺通过三乙胺作碱进行实验,反应在室温下顺利进行,得到相应的4-甲氧基苯基叠氮化物。该反应中,可以检测到副产物DMI,类似于以上提到的1,3-二羰基化合物的重氮化反应(表1)。因为DMI与目标产物极性相差很大,它们很容易分离。
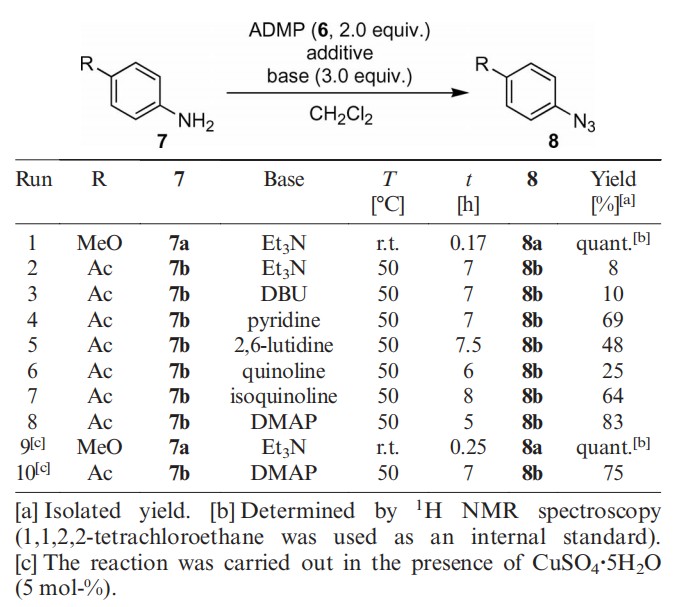
表1
然后就是与对乙酰苯胺的反应实验,对乙酰苯胺是一种不适合与TfN3进行重氮化转移的底物。当三乙胺作碱时,得到的叠氮化物仅有8%,即使提高反应温度至50℃反应7小时效果也不好。实验表明强碱或有机碱如DBU都不适合此反应,但发现吡啶型碱有较好的效果,通过使用DMAP作碱收率达到83%,添加五水硫酸铜没有显著效果。同时也做了苯胺与ADMC的实验,结果与ADMP相比产率偏低。
为了探索该反应的范围,以DMAP作碱将多种伯胺与ADMP反应。在实验1-13中(表2)显示,非取代苯胺和具有给电子基团的苯胺在室温下与ADMP反应,均以高产率得到相应的叠氮化物。使用微过量的ADMP与单卤代苯胺在50℃反应,产品收率也很高。强吸电子基团取代的苯胺(如乙酰基、氰基和硝基),使用过量的ADMP在DMAP作用下也有不错的收率。在邻位二取代苯胺的情况下,取代基的作用是显著的。无论空间位阻如何,具有二甲基的苯胺都以良好的产率得到相应的叠氮化物,而二氯苯胺仅得到22%的叠氮化物,这可能是由于低亲核性导致。1-萘胺也与相应的苯胺有类似地反应。
接下来,研究了ADMP与伯烷基胺的反应。以DMAP作碱与2-苯基乙胺的反应中,仅有21%的收率,并生成79%的胍。当用三乙胺作碱时,收率增至74%。同样,在环己胺重氮化时,三乙胺作碱优于DMAP。而仲烷基胺和叔烷基胺以DMAP作碱时有较高的转化率。
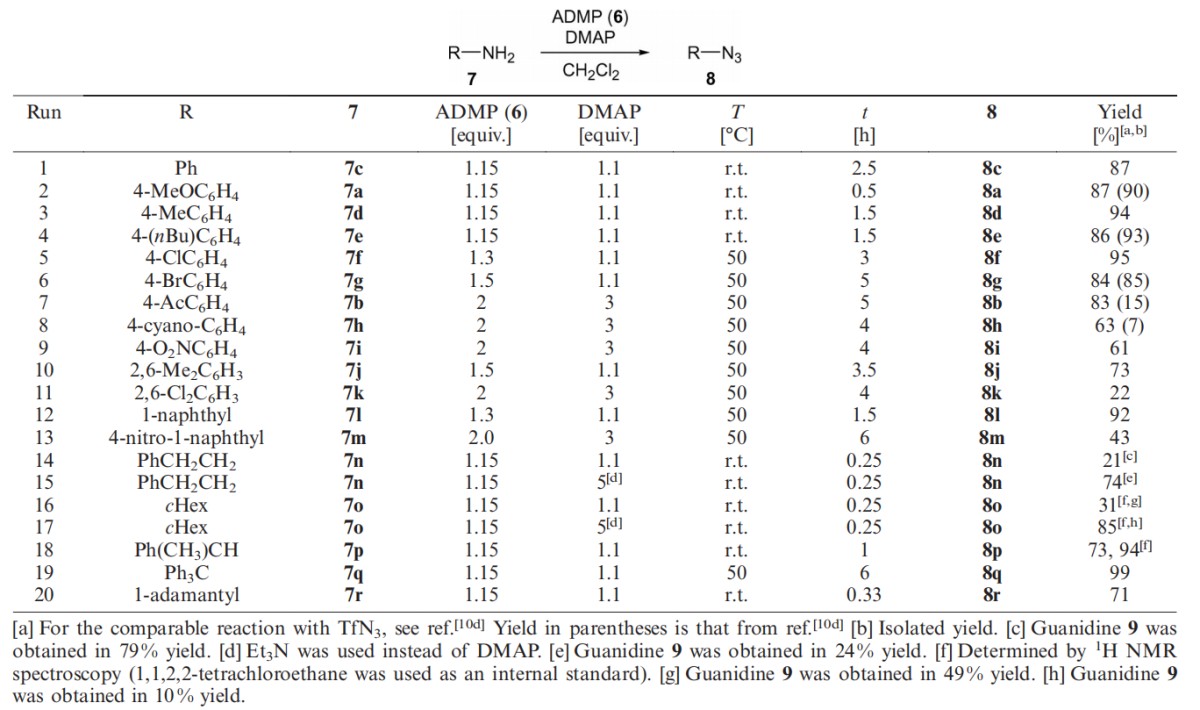
表2
研究表明(图3),反应中亲核性强的碱更适合高度亲核的伯胺,其有两种作用:中和生成的酸和活化ADMP。基于这一考虑,与伯胺相比在碱更亲核的情况下,碱首先与ADMP反应生成中间体Ⅰ,然后被伯胺取代生成中间体Ⅱ、六氟磷酸盐和碱,中间体Ⅱ发生分子内质子转移从而生成相应的叠氮化合物。在伯胺比碱更亲核情况下,伯胺在ADMP的a和b位置攻击,分别生成胍和相应的叠氮化合物。
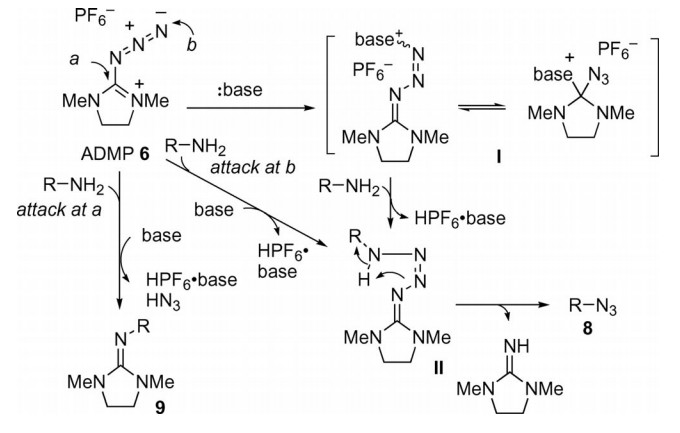
图3

